| Публикации: | АСУТП | Теория и технология | Научные работы | Главная |
Известия ВУЗов. Черная металлургия. 2003. №11. С.
В литературе критерии равновесия (со ссылкой на Гиббса) выводятся следующим образом: утверждается, что равновесному состоянию закрытой многофазной системы соответствуют экстремальные значения термодинамических потенциалов системы (минимум энергии Гиббса G, максимум энтропии S и т.д.) при условии постоянства соответствующих термодинамических переменных (для S—E и V, для G—p и T) и выполнении уравнений материального баланса. Для практического использования этот критерий обычно записывают в виде производных, т.е. в терминах химических потенциалов.
Считается, что такая постановка задачи является обычным поиском условного экстремума функции многих переменных при наличии уравнений связи между независимыми переменными (ограничений) в виде равенств, что приводит к использованию метода Лагранжа. Общий ход дальнейших рассуждений заключается в следующем.
1. Выбирается определенный термодинамический потенциал многофазной системы (равный сумме соответствующих потенциалов отдельных фаз), например, свободная энергия:
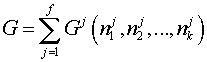 | (1) |
где 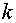 — число
компонентов системы;
— число
компонентов системы; 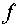 — число
возможных фаз;
— число
возможных фаз; 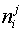 — количество компонента
— количество компонента
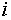 в фазе
в фазе 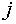 .
.
2. Записываются условия постоянства соответствующих выбранному потенциалу термодинамических переменных (в данном случае — p и T) и ограничения материального баланса на суммарные количества каждого компонента системы. Последние в простейшем случае (все фазы состоят из одинаковых компонентов) имеют вид
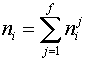 , , 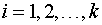 | (2) |
где 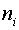 — общее количество компонента
— общее количество компонента 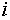 в системе.
в системе.
3. Записывается функция Лагранжа в виде суммы рассматриваемой функции и всех имеющихся ограничений, помноженных на «неопределенные множители Лагранжа»:
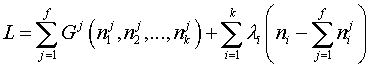 | (3) |
где 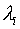 — неопределенные множители Лагранжа.
— неопределенные множители Лагранжа.
4. Производится поиск безусловного экстремума полученной функции (производные по всем независимым переменным, в том числе по неопределенным множителям, должны быть равны нулю). Число получаемых при этом уравнений строго равно числу неизвестных, т.е. система должна иметь единственное решение. В результате получают критерии равновесия в виде равенства во всех фазах температуры, давления и химических потенциалов компонентов, образующих замкнутую систему:
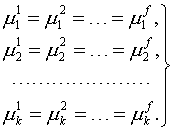 | (4) |
Уравнения (4) совместно с (2) дают систему из 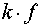 уравнений и
неизвестных и определяют равновесный состав системы.
уравнений и
неизвестных и определяют равновесный состав системы.
Указанный ход рассуждений действительно принадлежит Гиббсу, однако практическое использование такого критерия равновесия для расчета состава многофазной многокомпонентной системы требует некоторых дополнений.
Условие равенства химических потенциалов и давления во всех интересующих нас фазах (т.е. во всех возможных в данной системе) является достаточным, но не необходимым условием.
Более точно указанные критерии равновесия необходимо сформулировать в следующем виде: если установилось состояние равновесия, то во всех образовавшихся фазах (и только в них) температура, давление и химические потенциалы будут равны. Обратное утверждение, вообще говоря, неверно — записав систему уравнений с равенством химических потенциалов во всех возможных в данных условиях фазах мы можем и не получить равновесный состав системы (решения просто не будет — система окажется несовместной).
Для устранения этой проблемы в литературе фигурируют туманные рассуждения, что каких-то фаз (или отдельных компонентов в определенных фазах) может не быть в состоянии равновесия, если в этих фазах, существование которых возможно в данных условиях, даже при бесконечно малом количестве компонента его химический потенциал будет больше, чем в остальных фазах. В этом случае предлагается исключить такие условия равновесия и добавить вместо них условия равенства нулю масс соответствующих компонентов (попросту говоря, исключить эти фазы или компоненты из рассмотрения).
В общем виде проблему можно сформулировать следующим образом. Чтобы найти равновесный состав системы (перечень фаз и количества каждого компонента в них), нужно записать (и затем решить) соответствующую систему уравнений. Однако для этого необходимо знать фазовый состав системы, который станет известным лишь после нахождения ее равновесного состава и который не известен заранее.
Указанная проблема вовсе не порочит метод Гиббса или использованный метод Лагранжа. Дело в том, что Гиббс, рассматривая термодинамику как формальную схему, допускал отрицательные массы фаз. В этом случае система уравнений для любого набора фаз всегда будет иметь соответствующее решение (даже если в ответе будут фигурировать отрицательные массы).
В практических расчетах реальных равновесий отрицательные массы фаз не имеют физического смысла. Формальный анализ приведенной выше схемы рассуждений указывает на то, что при составлении функции Лагранжа пропущены условия неотрицательности масс компонентов в фазах (подразумевается, что это и так ясно):
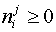 | (5) |
На самом деле, это такие же дополнительные условия (ограничения), как и условия материального баланса, только в виде неравенств, а не уравнений. Учет в функции Лагранжа (либо в виде дополнительных ограничений, либо в результате замены переменных) после выполнения описанных выше преобразований приводит к следующей формулировке критериев химического равновесия:
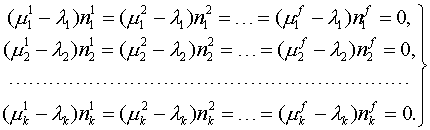 | (6) |
В отличие от (4), в систему уравнений (6) могут быть записаны абсолютно все фазы, существование которых возможно в данной системе, даже если их количество будет превышать количество независимых компонентов (т.е. противоречить правилу фаз). В результате решения «лишние» фазы будут исключены из ответа (их массы станут равными нулю). При этом уравнения (6) останутся справедливыми и в ситуации отсутствия каких-либо компонентов или фаз: при строго нулевой массе компонента или фазы соответствующие уравнения становятся тождеством и автоматически исключаются из системы уравнений.
Неопределенные множители
Лагранжа 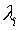 в (6) имеют простой физический смысл —
химический потенциал компонента
в (6) имеют простой физический смысл —
химический потенциал компонента 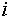 в системе.
Решение каждого уравнения в (6) естественным
образом распадается на два случая. Если в состоянии равновесия компонент
в системе.
Решение каждого уравнения в (6) естественным
образом распадается на два случая. Если в состоянии равновесия компонент 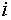 присутствует в
фазе
присутствует в
фазе 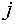 , то его химический потенциал в этой фазе должен быть равен
химическим потенциалам этого же компонента во всех остальных фазах, имеющихся в
состоянии равновесия. Если же компонента
, то его химический потенциал в этой фазе должен быть равен
химическим потенциалам этого же компонента во всех остальных фазах, имеющихся в
состоянии равновесия. Если же компонента 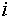 нет в фазе
нет в фазе 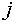 , то на его химический потенциал никаких ограничений
не накладывается (уравнение становится тождеством).
, то на его химический потенциал никаких ограничений
не накладывается (уравнение становится тождеством).
Таким образом, система
уравнений (6) совместно с (2) и (5) имеет 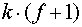 неизвестных и уравнений и позволяет
корректно поставить и решить задачу определения количества и состава фаз в
равновесном состоянии. Система является более общим критерием равновесия,
чем (4), поскольку учитывает случаи произвольного (не
известного заранее) набора фаз в состоянии равновесия.
неизвестных и уравнений и позволяет
корректно поставить и решить задачу определения количества и состава фаз в
равновесном состоянии. Система является более общим критерием равновесия,
чем (4), поскольку учитывает случаи произвольного (не
известного заранее) набора фаз в состоянии равновесия.
Недостаточность (4) проявляется и в других приложениях метода Гиббса.
Например,
предлагается (Пономаренко
А.Г. Вопросы термодинамики фаз переменного состава, имеющих коллективную электронную
систему // ЖФХ. — 1974. — Т.48. — №7. — С.
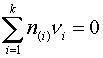 | (7) |
а на основе привлечения дополнительных предположений относительно физической природы шлака в уравнение химического потенциала компонента солевого раствора вводится дополнительное слагаемое
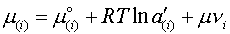 | (8) |
где
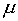 — химический потенциал электронов или
уровень Ферми (не контролируемый никакими методами анализа),
— химический потенциал электронов или
уровень Ферми (не контролируемый никакими методами анализа), 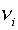 — степень окисления элемента
— степень окисления элемента 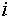 в фазе.
в фазе.
В действительности
необходимость введения в (8) дополнительного слагаемого 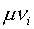 и дополнительных предположений относительно
физической природы шлака отсутствует. Дл этого достаточно учесть, что (7) является таким же
дополнительным условием (ограничением), как и (2), поэтому его необходимо включать в функцию Лагранжа (3) наравне со всеми
остальными ограничениями. В простейшем случае (система
и дополнительных предположений относительно
физической природы шлака отсутствует. Дл этого достаточно учесть, что (7) является таким же
дополнительным условием (ограничением), как и (2), поэтому его необходимо включать в функцию Лагранжа (3) наравне со всеми
остальными ограничениями. В простейшем случае (система
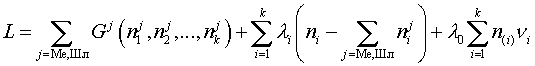 | (9) |
Дифференцируя (9)
по неизвестным и приравнивая полученные производные
нулю, получим (в случае постоянных 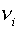 ):
):
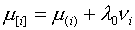 | (10) |
Величина
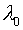 вычисляется
одновременно с составами фаз при решении системы уравнений (2), (7), (10) и имеет определенный физический смысл,
характеризуя, например, окисленность системы (её можно связать с уровнем Ферми
вычисляется
одновременно с составами фаз при решении системы уравнений (2), (7), (10) и имеет определенный физический смысл,
характеризуя, например, окисленность системы (её можно связать с уровнем Ферми 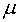 , парциальным давлением кислорода
, парциальным давлением кислорода 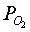 и т.д.).
и т.д.).
Таким
образом, формулы
Уравнение (10)
при подстановке 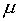 в качестве
в качестве 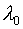 можно
интерпретировать следующим образом:
можно
интерпретировать следующим образом: 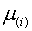 представляет
собой «внутренний» (т.е. «ионный») химический потенциал элемента
представляет
собой «внутренний» (т.е. «ионный») химический потенциал элемента 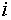 в фазе, а
в фазе, а 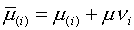 — изменение энергии Гиббса фазы при добавлении
электронейтрального атома
— изменение энергии Гиббса фазы при добавлении
электронейтрального атома 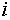 (вместе с
(вместе с 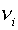 электронами),
т.е. «внешний» («видимый» другими фазами) химический потенциал элемента
электронами),
т.е. «внешний» («видимый» другими фазами) химический потенциал элемента 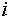 .
.
Интересно
отметить, что использование величин 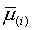 для вычисления
свободной энергии шлака в виде
для вычисления
свободной энергии шлака в виде
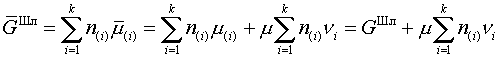 | (11) |
дает для электронейтральной фазы исходное выражение
для свободной энергии шлака (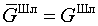 ), поскольку второе слагаемое в в соответствии с тождественно равно нулю.
), поскольку второе слагаемое в в соответствии с тождественно равно нулю.
Однако использование (11) в (3) сразу приводит к результату (10) без привлечения (7) в качестве дополнительного ограничения. Более того, уравнение (7) получается автоматически при дифференцировании функции Лагранжа (3) по переменной 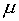 :
:
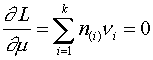 | (11) |
т.е. выражение (11) уже содержит «внутри себя» ограничение на состав шлака (7).
Выводы. Таким образом, проведенный анализ свидетельствует о том, что при выводе критериев равновесия методом неопределенных множителей Лагранжа для получения корректных результатов в число дополнительных условий необходимо включать все известные априорные данные как в виде уравнений, так и в виде неравенств (такие, как ограничения материального баланса, неотрицательности масс компонентов фаз, электронейтральности оксидных фаз и другие).
© С.А. Храпко, 2003
| Вверх |